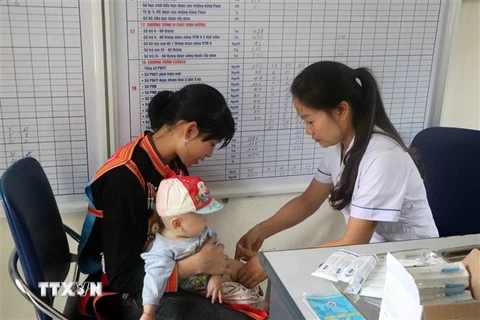
Vắcxin ComBE Five. (Nguồn: cphi-online.com)
Vắcxin ComBE Five. (Nguồn: cphi-online.com) Tin từ Bộ Y tế ngày 18/12 cho hay, căn cứ kết quả chuyển đổi sử dụng vắcxin DPT-VGB-Hib (ComBE Five) tại 7 tỉnh, đơn vị này cho phép triển khai vắcxin ComBE Five trên quy mô toàn quốc từ cuối tháng 12/2018.
Thời gian vừa qua, Bộ Y tế đã triển khai vắcxin DPT-VGB-Hib (ComBE Five) do Công ty Biological E. Ltd Ấn Độ sản xuất, thay thế vắcxin Quinvaxem trong tiêm chủng mở rộng tại 7 tỉnh là Hà Nam, Bắc Giang, Yên Bái, Kon Tum, Bình Định, Đồng Tháp, Bà Rịa-Vũng Tàu.
[Thủ tướng trả lời chất vấn về chế độ, chính sách đối với cán bộ y tế]
Thời gian triển khai vắcxin ComBE Five tại 7 tỉnh muộn hơn so với kế hoạch dự kiến do loại vắcxin này được cung ứng thông qua UNICEF cho Việt Nam vào ngày 4/10/2018.
Ngay sau khi nhận được giấy chứng nhận xuất xưởng vắcxin, sinh phẩm của Viện Kiểm định Quốc gia vắcxin và sinh phẩm y tế cho lô vắcxin, ngày 15/10/2018, Viện Vệ sinh dịch tễ Trung ương, Dự án tiêm chủng mở rộng đã phân bổ vắcxin cho 7 tỉnh để triển khai tiêm cho trẻ 2, 3 và 4 tháng tuổi vào ngày tiêm chủng thường xuyên của tháng 10 và tháng 11/2018.
Các địa phương đã thực hiện triển khai ngay sau khi được cung ứng vắcxin ComBE Five. Trong đó, 4 tỉnh triển khai trong tháng 10/2018 là Hà Nam, Bà Rịa Vũng Tàu, Bắc Giang (2 huyện), Bình Định (5 huyện); 3 tỉnh còn lại làYên Bái, Kon Tum, Đồng Tháp và các huyện còn lại của Bắc Giang triển khai trong tháng 11/2018.
Kết quả tính đến thời điểm ngày 30/11/2018, đã triển khai tại 60 huyện, 899 xã/phường, đã có 17.356 trẻ đã được tiêm vắcxin ComBE Five, tỷ lệ tiêm chủng đạt 75,7%.
Vắcxin ComBE Five đã được triển khai an toàn. Việc theo dõi phản ứng sau tiêm vắc xin ComBE Five được thực hiện chủ động, chặt chẽ trong 3 ngày đầu sau tiêm chủng.
Theo báo cáo của các địa phương, tỷ lệ phản ứng thông thường (sốt<39°C, sưng đau nhẹ tại chỗ tiêm, các triệu chứng khác như khó chịu, quấy khóc...) là 5,5 %.
Có 3 trường hợp phản ứng phải nhập viện điều trị đã được Hội đồng chuyên môn đánh giá nguyên nhân phản ứng sau tiêm chủng: 2 trường hợp phản ứng phản vệ, 1 trường hợp sốt cao/co giật đã được xử trí ban đầu và cấp cứu kịp thời tại bệnh viện. Không có trường hợp tử vong.
Việc chuyển đổi sử dụng vắcxin DPT-VGB-Hib (ComBE Five) tại 7 tỉnh đã được sự chấp nhấp nhận của cộng đồng. Không có trường hợp từ chối không tiêm chủng vắcxin./.
Vắcxin phối hợp bạch hầu, ho gà, uốn ván, viêm gan B và viêm phổi/viêm màng não mủ do vi khuẩn Hib (ComBE Five) do Công ty Biological E, Ấn Độ sản xuất loại 1 liều/lọ tương tự như vắc xin Quinvaxem đã được cấp số đăng ký lưu hành tại Việt Nam và được Bộ Y tế cho phép sử dụng trong tiêm chủng mở rộng.
Vắcxin này phòng các bệnh truyền nhiễm nguy hiểm như bạch hầu, uốn ván, ho gà, viêm gan B và viêm phổi, viêm màng não mủ do Haemophilus influenzae týp b.